En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema físico.
Proceso Isotérmico
Es un proceso en el cual la temperatura permanece constante durante la operación. La energía interna de un gas es función de la temperatura exclusivamente.
Es un proceso a temperatura constante. En general, ninguna de las cantidades , Q y W son nulas.
, Q y W son nulas.
Es un proceso a temperatura constante. En general, ninguna de las cantidades
Hay una excepción: la energía interna de un gas perfecto depende solamente de la temperatura. En consecuencia, para un gas perfecto , y Q = W
, y Q = W
Se denomina gas perfecto a un gas que sigue sigue la ley pv = nRT, donde n es el número de moles, y R una constante.
Proceso Isobárico
Es un proceso a presión constante; en consecuencia:

Donde:
 = Calor transferido.
= Calor transferido. = Energía Interna.
= Energía Interna.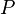 = Presión.
= Presión. = Volumen.
= Volumen.- En un diagrama P-V, un proceso isobárico aparece como una línea horizontal.
Si la presión no cambia durante un proceso, se dice que éste es isobárico. Un ejemplo de un proceso isobárico es la ebullición del agua en un recipiente abierto. Como el contenedor está abierto, el proceso se efectúa a presión atmosférica constante. En el punto de ebullición, la temperatura del agua no aumenta con la adición de calor, en lugar de esto, hay un cambio de fase de agua a vapor.
Procesos Isocóricos
También llamado proceso isométrico o isovolumétrico es un proceso termodinámico en el cual el volumen permanece constante.
W = 0, y tendremos:
En un recipiente de paredes gruesas que contiene un gas determinado, al que se le suministra calor, observamos que la temperatura y presión interna se elevan, pero el volumen se mantiene igual.
En un recipiente de paredes gruesas que contiene un gas determinado, al que se le suministra calor, observamos que la temperatura y presión interna se elevan, pero el volumen se mantiene igual.
En un proceso que se efectúa a volumen constante sin que haya ningún desplazamiento, el trabajo hecho por el sistema es cero.
Es decir, en un proceso isocórico no hay trabajo realizando por el sistema. Y no se adiciona calor al sistema que ocasione un incremento de su energía interna.
 Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:
Esto implica que el proceso no realiza trabajo presión-volumen, ya que éste se define como:
donde P es la presión (el trabajo es positivo, ya que es ejercido por el sistema).
En un diagrama P-V, un proceso isocórico aparece como una línea vertical.
En termodinámica se designa como proceso adabiatico a aquél en el cual el sistema (generalmente, un fluido que realiza un trabajo) no intercambia calor con su entorno. Un proceso adiabático que es además reversible se conoce como proceso isoentrópico.
Procesos Diatérmicos
Un proceso diatérmico
quiere decir que deja pasar el calor fácilmente.
- · Una interacción térmica es cualquier otro tipo de intercambio de energía. En este caso la pared se denomina diatérmica.
- · Diatérmico también puede entenderse por isotérmico , significa que no hay cambio de temperatura debido a una pared diatérmica que aísla el sistema del medio ambiente
- · En cuanto diatérmicos se refieren a que el sistema tiene un intercambio de energía con los alrededores, un ejemplo, nosotros, los seres humanos, somos sistemas diatérmicos, ya que estamos intercambiando energía con nuestro ambiente
- · Una pared diatérmica es aquella que permite la transferencia de energía térmica (calor) pero, sin que haya transferencia de masa. El opuesto es una pared adiabática que es la que impide la transferencia de energía en forma de calor.
- · Cualquier superficie real es una superficie diatérmica, por ejemplo, un vaso, los muros de una casa, etc., todos en mayor o menor grado permiten la transferencia de calor.







No hay comentarios:
Publicar un comentario